Esta entrada trata de recoger información de las recomendaciones institucionales de cual debe de ser el periodo de aislamiento de los pacientes e información sobre en que basar la decisión (en criterios clínicos y/o pruebas diagnósticas)
(Se presenta un resumen de documentos institucionales y de artículos científicos actualizado a 10 de septiembre de 2020)
- Documento del Ministerio de Sanidad y Consumo (España). Estrategia de detección precoz, vigilancia y control de covid-19 (1). 10 de septiembre de 2020. Visitado el 10 de septiembre.
Manejo de los casos COVID con infección activa
Todos los casos sospechosos se mantendrán en aislamiento a la espera del resultado de la PCR y se iniciará la búsqueda de sus contactos estrechos convivientes. En caso de PCR negativa, y si no hay una alta sospecha clínica, el caso se da por descartado y finaliza el aislamiento
- Ámbito de atención primaria
En los casos que no requieran ingreso hospitalario y sean manejados en el ámbito de atención primaria, se indicará aislamiento domiciliario, siempre que pueda garantizarse el aislamiento efectivo. Cuando éste no pueda garantizarse se indicará el aislamiento en hoteles u otras instalaciones habilitadas para tal uso. En las personas desplazadas fuera de su localidad de residencia en el momento del diagnóstico, las autoridades sanitarias podrán valorar otras alternativas siempre que garanticen la seguridad.
Siguiendo las recomendaciones del ECDC(7) y el CDC, el aislamiento se mantendrá hasta transcurridos tres días desde la resolución de la fiebre y del cuadro clínico, con un mínimo de 10 días desde el inicio de los síntomas y no será necesario la realización de una PCR para levantar el aislamiento.
En los casos asintomáticos el aislamiento se mantendrá hasta transcurridos 10 días desde la fecha de toma de la muestra para el diagnóstico. El seguimiento será supervisado hasta el alta epidemiológica de la forma que se establezca en cada comunidad autónoma.
- Ámbito hospitalario
Los casos que requieran ingreso hospitalario serán aislados durante su estancia en el hospital siguiendo las precauciones estándar, de contacto y precauciones de transmisión por gotas y serán manejados según los protocolos de cada centro.
Los casos que han requerido ingreso hospitalario podrán recibir el alta hospitalaria si su situación clínica lo permite aunque su PCR siga siendo positiva, pero se deberá mantener aislamiento domiciliario con monitorización de su situación clínica al menos 14 días desde el alta hospitalaria. A partir de estos 14 días, y siempre que hayan transcurrido tres días desde la resolución de la fiebre y el cuadro clínico, se podrá finalizar el aislamiento. En cualquier caso, si antes de transcurridos estos 14 días de aislamiento domiciliario desde el alta hospitalaria se realiza una PCR y se obtiene un resultado negativo, se podrá desaislar al paciente.
En caso de tener la última PCR negativa en el momento del alta hospitalaria y no presentar síntomas respiratorios en los tres días previos, se considerará que la infección está resuelta y se podrá dar el alta sin necesidad de aislamiento en domicilio. En cualquier caso, se seguirá lo establecido en cada CCAA.
El personal sanitario y socio-sanitario que resulten casos confirmados y no requieran ingreso hospitalario serán manejados de la misma forma que la población general en cuanto al aislamiento. Para la reincorporación a su puesto de trabajo será necesaria la realización de una PCR además de la resolución de síntomas al menos 3 días antes, y con un mínimo de 10 días desde el inicio de los síntomas
- Documento del Ministerio de Sanidad y Consumo. INFORMACIÓN CIENTÍFICA-TÉCNICA. Enfermedad por coronavirus, COVID-19. Actualizado a 28 de agosto 2020 (2). Visitado el 10 de Septiembre.
Periodo infectivo: aproximación desde las diversas técnicas de laboratorio y la epidemiología.
El periodo en el que un caso puede transmitir la infección a otra persona puede ser inferido mediante la detección de virus viable en muestras clínicas. La técnica RT-PCR ha sido ampliamente utilizada a lo largo de la pandemia COVID-19 con cierta controversia, por su capacidad para detectar la carga RNA viral durante periodos muy largos que no siempre pueden ser relacionados con virus con capacidad infectiva.
Mediante la técnica de RT-PCR se ha observado que los infectados presentan en su mayoría una alta carga viral antes del inicio de los síntomas y en los primeros días de la aparición de la clínica.
En personas con un curso leve de infección, el pico de la carga viral en muestras nasales y orofaríngeas ocurre durante los primeros 5-6 días tras el inicio de síntomas y prácticamente desaparece al día 10 (Si bien en algunos pacientes se detecta virus más allá del día 10). En personas con síntomas leves, más allá de la primera semana tras el inicio de síntomas, la probabilidad de transmitir la infección a otros sería muy baja, incluso cuando el virus aún es detectable mediante PCR (3)(4). En personas con un curso clínico más grave la carga viral es de hasta 60 veces mayor que las que tienen un curso más leve y la carga viral elevada puede ser más duradera(5) más allá incluso de la 3ª semana (33% de los casos) (6).
La presencia de positividad en la prueba PCR u otra técnica de detección de ácidos nucleicos no implica necesariamente infecciosidad.
Figura 1. Dinámica de la reducción de la carga viral, en casos leves-asintomáticos (línea verde), graves (línea roja) y críticos (línea naranja).
Fuente de elaboración: Ministerio de Sanidad y Consumo. España
La conclusión del documento del Ministerio (28 de agosto 2020) es:
“La transmisión de la infección ocurriría fundamentalmente en los casos leves en la primera semana de la presentación de los síntomas, desde 2-3 días antes hasta 7-8 días después. En los casos más graves esta transmisión sería más intensa y más duradera”.
- Informe European Centre for Disease Prevention and Control (ECDC): Recomendaciones para finalizar aislamiento en el contexto de transmisión comunitaria de COVID-19 (8 de abril 2020) (7) Visitado el 10 de septiembre de 2020.
Infección en individuos asintomáticos:
Se ha notificado infección asintomática en el momento de la confirmación mediante prueba diagnóstica, posteriormente estos pacientes en ocasiones presentaron síntomas característicos de la infección(8). Se ha detectado ARN viral en pacientes asintomáticos(9).
Transmisión en la etapa presintomática de la infección:
En pacientes sintomáticos, la alta carga viral cercana a la aparición de los síntomas sugiere que sarS-CoV-2 puede ser fácilmente transmisible en una etapa temprana de la infección. La transmisión presintomática se ha inferido mediante el modelado, y la proporción de transmisión presintomática se estimó entre el 48% y el 62% (10).La transmisión presintomática suele aparecer 4 a 4,6 días después del contagio.
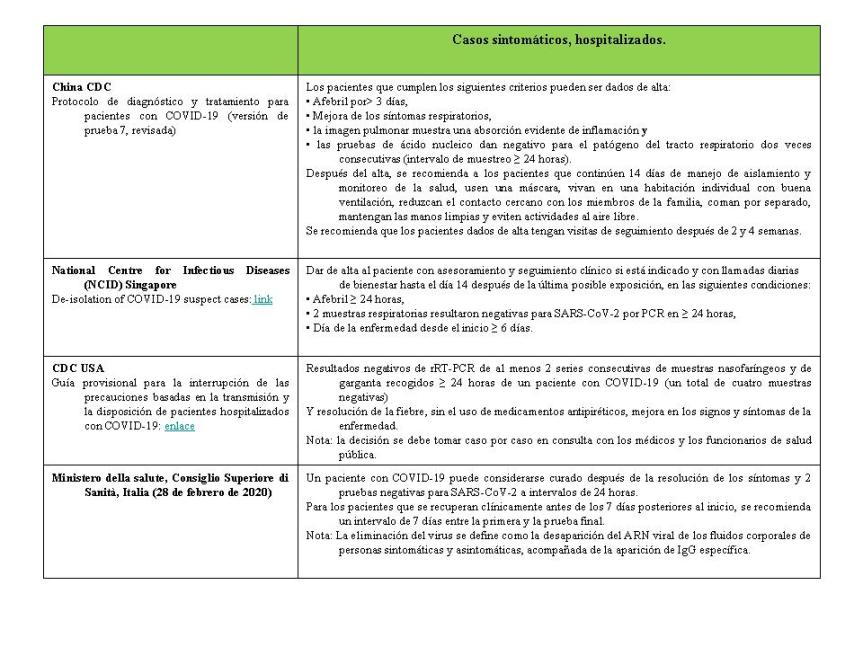
- Informe European Centre for Disease Prevention and Control (ECDC): Criterios de alta para los casos confirmados de COVID-19: ¿cuándo es seguro dar de alta los casos de COVID-19 del hospital o finalizar el aislamiento en el hogar? (10 de marzo 2020)(11) Visitado 10 de septiembre de 2020.
El informe recoge en una tabla resumen la Comparación de las directrices actuales sobre el aislamiento de los casos de COVID-19
- CDC Centers for Diseases Control and Prevention. Guía provisional para la finalización del aislamiento en el hogar para pacientes con COVID-19 (20 de julio 2020). Visitado 10 de septiembre 2020.
En estos momentos existen suficientes evidencias como para utilizar sólo una estrategia basada en síntomas.
5.1 Fin del aislamiento en personas COVID-19 con síntomas
Las personas con COVID-19 que tienen síntomas y se las recomendó aislarse en su domicilio pueden acabar dicho aislamiento si se dan las siguientes condiciones:
- Han pasado al menos 10 días* desde que aparecieron los síntomas por primera vez Y
- Han pasado al menos 24 horas desde la última fiebre sin el uso de medicamentos para reducir la fiebre Y
- Los síntomas (p. ej., tos, dificultad para respirar) han mejorado
* Los pacientes con un curso leve-moderado de la enfermedad permanecen infectivos hasta el día 10 desde el inicio de los síntomas y las personas con un curso grave permanecen infectivos hasta el día 20 desde el inicio de los síntomas.
5.2 Fin del aislamiento en personas COVID-19 que no han desarrollado síntomas
Pueden interrumpir el aislamiento 10 días después de la fecha de su primera prueba positiva de RT-PCR para el ARN SARS-CoV-2. Si no ha desarrollado ningún síntoma.
Los CDC ya no recomiendan una estrategia de “Fin de aislamiento domiciliario” basado en pruebas diagnósticas (PCR). Recomiendan la utilización de la PCR para interrumpir el aíslamiento en pacientes gravemente inmunocomprometidos.
- Organización Mundial de la Salud. Atención en el domicilio de pacientes presuntamente infectados por el nuevo coronavirus (nCoV) que tengan síntomas leves y gestión de los contactos, 12 de Agosto del 2020 (12) Visitado 10 de septiembre 2020.
Este documento contiene nuevas recomendaciones sobre cómo atender en el domicilio de forma segura y adecuada a los pacientes con coronavirus de 2019 (COVID-2019), así como sobre las medidas de salud pública relativas al manejo de sus contactos.
Respecto al tema que nos ocupa, en su apartado “Fin del aislamiento de los pacientes con COVID19 en el domicilio” señala:
Los pacientes atendidos en el domicilio deben permanecer aislados hasta que dejen de ser infecciosos:
- En el caso de las personas asintomáticas, diez días desde el resultado positivo (PCR)
- Los pacientes con COVID-19 a los que se atiende en el domicilio o que han recibido el alta hospitalaria deben permanecer aisladas durante un mínimo de 10 días desde el inicio de los síntomas, más otros 3 días desde su desaparición, es decir, desde que dejaron de tener fiebre y síntomas respiratorios.
La OMS recuerda que el aislamiento es una medida importante que adoptan las personas con síntomas de COVID‑19 para evitar infectar a otras personas.
- UpToDate (visitado 10 de Septiembre 2020)
Hace referencia al documento CDC «Guía provisional para la finalización del aislamiento en el hogar para pacientes con COVID-19” (Ir a punto 5. de este documento).
- “Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application” (13). Annals of internal medicine.
Este artículo recoge los resultados casos confirmados de COVID-19 notificados entre el 4 de enero de 2020 y el 24 de febrero de 2020, la fuente de información son informes de noticias y comunicados de prensa de 50 provincias (incluida la ciudad de Wuhan) de la provincia de Hubei, China. Se trata de 181 pacientes con diagnóstico confirmado con una mediana de edad de 44 años (RIC 34-55).
Los autores obtienen los siguientes resultados:
- La mediana del período de incubación se estimó en 5.1 días (IC 95%, 4.5 a 5.8 días), y el 97.5% de aquellos que desarrollan síntomas lo harán dentro de 11.5 días (IC, 8.2 a 15.6 días) de infección.
- Entre aquellos que desarrollaron síntomas en la comunidad, la mediana del tiempo desde el inicio de los síntomas hasta la hospitalización fue de 1.2 días (rango, 0.2 a 29.9 días)
- Estimamos que menos del 2.5% de las personas infectadas mostrarán síntomas dentro de los 2.2 días (IC, 1.8 a 2.9 días) de exposición, y el inicio de los síntomas ocurrirá dentro de los 11.5 días (IC, 8.2 a 15.6 días) para el 97.5% de las personas infectadas.
- Estas estimaciones implican que, bajo supuestos conservadores, 101 de cada 10.000 casos (percentil 99, 482) desarrollarán síntomas después de 14 días de monitoreo activo o cuarentena.
Concluyendo que:
- Estimamos que el período medio de incubación de COVID-19 es de 5,1 días y esperamos que casi todos los infectados las personas que tienen síntomas lo harán dentro de los 12 días de la infección.
- El periodo de 14 días de seguimiento y observación está adecuadamente documentado por los resultado de este trabajo y de otros similares, si bien para los períodos de observación más largos podrían estar justificados en casos extremos.
Transmisión de la infección por SARS-Cov-2
La carga viral en el tracto respiratorio superior parece alcanzar su máximo en el momento de la aparición de los síntomas y el contagio viral comienza aproximadamente 2 a 3 días antes de la aparición de los síntomas(15). Los portadores asintomáticos y presintomáticos pueden transmitir SARS-CoV-2 (16)(17).
En Singapur, la transmisión presintomática se ha descrito en grupos de pacientes con contacto cercano aproximadamente 1 a 3 días antes de que el paciente índice desarrollara síntomas(16). Se cree que la transmisión presintomática es un importante contribuyente a la propagación del SARS-CoV-2. Los estudios basados en modelos en China y Singapur estimaron que el porcentaje de infecciones transmitidas de un individuo presintomático era del 48% al 62% (10). La diseminación faríngea es alta durante la primera semana de infección momento en el que los síntomas son leves, lo que favorece la diseminación(3).
Aunque los estudios han descrito frecuencias de infección asintomática que van del 4% al 32%, no está claro si estos trabajos describen una infección verdaderamente asintomática, es decir, individuos que nunca desarrollan síntomas, transmisión por individuos con síntomas muy leves, o transmisión por individuos que son asintomáticos en el momento de la transmisión, pero que posteriormente desarrollan síntomas(18)(19). Una revisión sistemática sobre este tema sugirió que la verdadera infección asintomática es probablemente poco frecuente(19).
Aunque el ácido nucleico viral puede ser detectable en hisopos de garganta hasta 6 semanas después de la aparición de la enfermedad, varios estudios sugieren que los cultivos virales son generalmente negativos para SARS-CoV-2 unos 8 días después de la aparición de los síntomas(15)(3). Esto está respaldado por estudios epidemiológicos que han demostrado que la transmisión no se produjo en los contactos con el caso índice 5 días después de la aparición de los síntomas , lo que sugiere que se puede finalizar el aislamiento basado en la mejoría clínica (20).
Autores: Ricardo Rodríguez Barrientos y Jesús Redondo Sánchez (Gdt Enfermedades Infecciosas SoMaMFyC)
Podéis descargar esta revisión en pdf el siguiente link
Bibliografía
- Ministerio de Sanidad y Consumo. COVID19_Estrategia_vigilancia_y_control_e_indicadores 10092020. 2020; Available from: https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/COVID19_Estrategia_vigilancia_y_control_e_indicadores.pdf
- Consumo M de S y. INFORMACIÓN CIENTÍFICA-TÉCNICA COVID. 2020; Available from: https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/ITCoronavirus.pdf
- Wölfel R, Corman VM, Guggemos W, Seilmaier M, Zange S, Müller MA, et al. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020 May;581(7809):465–9.
- Scola B La, Bideau M Le, Andreani J, Hoang VT, Grimaldier C. Viral RNA load as determined by cell culture as a management tool for discharge of SARS-CoV-2 patients from infectious disease wards. 2020;1059–61.
- Liu Y, Yan L-M, Wan L, Xiang T-X, Le A, Liu J-M, et al. Viral dynamics in mild and severe cases of COVID-19. Vol. 20, The Lancet. Infectious diseases. 2020. p. 656–7.
- Delgado R. Persistent SARS-CoV-2 replication in severe COVID-19. 2020;2–13.
- The European Centre for Disease Prevention and Control. Guidance for discharge and ending isolation in the context of widespread community transmission of COVID-19 – first update Target audience Scientific evidence on SARS-CoV-2 shedding. 2020;(April).The European Centre for Disease Prevention and Control. Novel coronavirus ( SARS-CoV-2 ). 2020;
- To KK-W, Tsang OT-Y, Leung W-S, Tam AR, Wu T-C, Lung DC, et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis. 2020 May;20(5):565–74
- Hoehl S, Rabenau H, Berger A, Kortenbusch M, Cinatl J, Bojkova D, et al. Evidence of SARS-CoV-2 Infection in Returning Travelers from Wuhan, China. Vol. 382, The New England journal of medicine. 2020. p. 1278–80.
- Ganyani T, Kremer C, Chen D, Torneri A, Faes C, Wallinga J, et al. Estimating the generation interval for coronavirus disease (COVID-19) based on symptom onset data, March 2020. Euro Surveill Bull Eur sur les Mal Transm = Eur Commun Dis Bull. 2020 Apr;25(17).
- The European Centre for Disease Prevention and Control. Novel coronavirus ( SARS-CoV-2 ). 2020;
- Organización Mundial de la Salud (OMS). Atención en el domicilio a casos sospechosos o confirmados de COVID-19 y manejo de sus contactos. 2020; Available from: https://apps.who.int/iris/bitstream/handle/10665/333967/WHO-2019-nCoV-IPC-HomeCare-2020.4-spa.pdf?sequence=1&isAllowed=y
- Lauer SA, Grantz KH, Bi Q, Jones FK, Zheng Q, Meredith HR, et al. The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application. Ann Intern Med. 2020 May;172(9):577–82.
- Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (COVID-19): A Review. JAMA. 2020 Jul;
- He X, Lau EHY, Wu P, Deng X, Wang J, Hao X, et al. Temporal dynamics in viral shedding and transmissibility of COVID-19. Nat Med. 2020 May;26(5):672–5.
- Wei WE, Li Z, Chiew CJ, Yong SE, Toh MP, Lee VJ. Presymptomatic Transmission of SARS-CoV-2 – Singapore, January 23-March 16, 2020. MMWR Morb Mortal Wkly Rep. 2020 Apr;69(14):411–5
- Bai Y, Yao L, Wei T, Tian F, Jin D-Y, Chen L, et al. Presumed Asymptomatic Carrier Transmission of COVID-19. JAMA. 2020 Feb
- Park SY, Kim Y-M, Yi S, Lee S, Na B-J, Kim CB, et al. Coronavirus Disease Outbreak in Call Center, South Korea. Emerg Infect Dis. 2020 Apr;26(8).
- Tabata S, Imai K, Kawano S, Ikeda M, Kodama T, Miyoshi K, et al. Clinical characteristics of COVID-19 in 104 people with SARS-CoV-2 infection on the Diamond Princess cruise ship: a retrospective analysis. Lancet Infect Dis. 2020 Jun
- Cheng H-Y, Jian S-W, Liu D-P, Ng T-C, Huang W-T, Lin H-H. Contact Tracing Assessment of COVID-19 Transmission Dynamics in Taiwan and Risk at Different Exposure Periods Before and After Symptom Onset. JAMA Intern Med. 2020 May;























 Criterios de actuación de los servicios de prevención de riesgos laborales del SERMAS para profesionales sanitarios frente a COVID 19 (Actualizado a 3 de abril). (11)
Criterios de actuación de los servicios de prevención de riesgos laborales del SERMAS para profesionales sanitarios frente a COVID 19 (Actualizado a 3 de abril). (11)